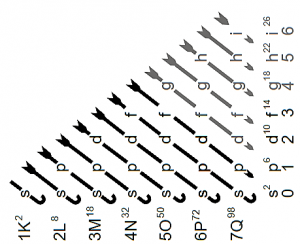
Diagrama de Moeller
El diagrama de Moeller es un diagrama que ayuda a conocer el orden en que los electrones llenan los orbitales dentro de una estructura atómica. Se compone de 4 columnas los cuales representan los orbitales definidos por la teoría (s, p, d y f, respectivamente).
Temas relacionados
Configuración electrónica, electrones de valencia, fracción molar, masa atómica, número atómico, número másico, orbitales atómicos, peso atómico
¿Qué es el diagrama de Moeller?
Con el desarrollo de la química a lo largo del siglo XIX, se hizo cada vez más latente la necesidad de una teoría apropiada que explicara los pormenores acerca de la estructura atómica. En ese orden, nació la teoría de los orbitales atómicos, la cual establece que los electrones permanecen dentro de un espacio asociado a una órbita determinada. Esto implica que, a mayor cantidad de electrones en el elemento, mayor es la cantidad de orbitales. Para poder expresar la configuración electrónica correspondiente a cada elemento se desarrolló el diagrama de Moeller, el cual representa gráficamente a la regla de Madelung y permite obtener dicha configuración de forma rápida y sencilla. También es conocido como el Método de la lluvia.
En qué consiste el diagrama de Moeller
Determina el orden de llenado, se trazan líneas diagonales apuntando hacia debajo, iniciando en la derecha y terminando en la izquierda. De tal manera se establece el comienzo del llenado en el orbital 1s; luego, el llenado electrónico corresponde al orbital 2s y así de forma sucesiva.
Historia
El diagrama de Moeller se desprende de la Regla de Madelung, la cual fue desarrollada por el físico alemán Erwin Madelung para explicar el orden energético asociado a los orbitales atómicos. También dicho diagrama tiene basamento en el famoso Principio de Pauli.
Quién lo inventó
Erwin Madelung fue un físico alemán nacido en Bonn en 1881 y es conocido como el responsable de la Regla de Madelung, de la cual se desprende el diagrama de Moeller. Su actividad intelectual estuvo principalmente dedicada al estudio de la física atómica y la mecánica cuántica. Fue catedrático de la Universidad de Goethe en Frankfurt y falleció en 1972.
Para qué sirve el diagrama de Moeller
Este método fue desarrollado como regla memotécnica de tal manera que se pueda expresar la configuración electrónica de un átomo en función del principio de Aufbau. Esto implica que los electrones son integrados en un orden especial uno a uno a cada orbital disponible tomando como referencia sus niveles de energía.
De esa forma, los primeros orbitales están conectados con los electrones de menor energía y los últimos orbitales se asocian con los electrones de mayor energía presentes en el átomo.
Como se hace
En primer lugar hay que determinar al número atómico Z del elemento a estudiar, el cual está asociado al número de electrones que se encuentran en un átomo neutro. Luego, se determina el llenado de los electrones en los orbitales a través del trazo de líneas diagonales apuntando hacia abajo, de izquierda a derecha.
De esa forma se establece el llenado desde el orbital 1s en adelante, siguiendo el orden presente en el diagrama. Cabe destacar que, para el caso de los orbitales “s” se alojan 2 electrones; del mismo modo, para los orbitales “p” se alojan 6 electrones y 10 electrones para los orbitales “d”, respectivamente.
Una forma elegante de reescribir la configuración electrónica para los átomos polielectrónicos es la siguiente: reescribir la configuración como la del gas noble que le precede más los electrones siguientes que corresponden.
Importancia del diagrama de Moeller
La importancia de este diagrama radica en que es una forma fácil y sencilla de explicar y calcular las configuraciones electrónicas del átomo con base a la Regla de Madelung. Esto permitió la masificación de la química como ciencia de estudio y fue punta de lanza para los desarrollos tecnológicos que se dieron a posteriori.
Ejemplos
Cálculo de la configuración electrónica del Potasio (K) utilizando el diagrama de Moeller
Inicialmente se debe conocer el número atómico Z del potasio (K) el cual, con base a la tabla periódica, corresponde a Z=19. Luego, asumiendo que dicho valor corresponde a la cantidad de electrones que existen en un átomo de potasio (K), se deben seguir las indicaciones relativas al trazo de las líneas diagonales para determinar el ordenamiento en el que se llenarán en los orbitales. Para el caso del potasio (K), se obtiene: 1s22s22p63s23p64s1.
Finalmente, por ser el potasio (K) un átomo polielectrónico, también puede reescribirse su configuración electrónica de la siguiente manera: [Ar] 4s1 ; representándose en este caso al símbolo [Ar] como la configuración electrónica asociada al elemento Argón (Ar), el cual es el gas noble que precede al potasio (K) en la tabla periódica.
¿Cómo citar este artículo?
Calderón, Grecia. (2019). Diagrama de Moeller. Recuperado el 3 mayo, 2025, de Euston96: https://www.euston96.com/diagrama-de-moeller/