Enlace covalente
Un enlace covalente es un tipo de enlace químico que se puede dar entre dos átomos o iones en los cuales los pares de electrones se comparten entre ellos. Un enlace covalente también puede denominarse enlace molecular. Los enlaces covalentes se forman de la unión de dos átomos que son no metálicos y que tienen valores de electronegatividad idénticos o relativamente cercanos. Este tipo de enlace también se puede encontrar en otras especies químicas, como radicales y macromoléculas. El término enlace covalente se empezó a utilizar por primera vez en 1939, aunque Irving Langmuir introdujo el término "covalencia" en 1919, término que utilizó para poder describir el número de pares de electrones compartidos por los átomos vecinos. Los pares de electrones que participan en un enlace covalente se llaman pares de enlace o pares compartidos. Por lo general, el intercambio de pares de enlaces permite que cada átomo logre tener una capa externa de electrones la cual es bastante estable, similar a la que se ve en los átomos de gases nobles.
¿Qué es el enlace covalente?
Los enlaces covalentes son los enlaces que se forman entre dos no metales y que pueden compartir sus electrones de valencia formando una molécula de varios átomos unidos entre sí, luego éstos adquieren la estructura de un gas noble.
Características del enlace covalente
Las principales características de los enlaces covalentes son las siguientes:
- Los enlaces se caracterizan por la unión entre dos pares de electrones que no sean metales.
- Los átomos que se unen al enlace deben de poder ganar electrones.
- Se da una pequeña electronegatividad entre los átomos.
- Se encuentran formados por no metales más no metales.
- Tienen la capacidad de formar moléculas
- Los enlaces covalentes son blandos cuando se encuentran en estado sólido.
- Son solubles en agua.
- Los electrones que se comparten se representan por medio de una única línea.
- Cada electrón del par que ha sido compartido es atraído por los núcleos de los dos átomos.
Cómo se forma un enlace covalente
El enlace covalente se forma cuando dos de sus átomos compartes uno o más pares de electrones. La diferencia de electronegatividad es al responsable de que el enlace pueda tener un carácter fuerte o de que sea débil o pequeña.
Clasificación
Dependiendo de la diferencia en la electronegatividad, los enlaces covalentes pueden ser clasificados en dos diferentes tipos, covalente apolar y covalente polar:
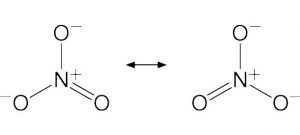
- Covalente apolar: es también conocido con el nombre de enlace covalente puro o no polar. Se produce debido al comportamiento de los electrones que se da entre dos o más átomos que tienen la misma electronegatividad, por lo que su resultado es de 0. Pueden distribuir su carga electrónica entre los núcleos de forma simétrica y el par electrónico es atraído por los dos núcleos. Cuando la electronegatividad es menor a 0,4 es covalente apolar.
- Covalente polar: este tipo de enlace es una transición que se da entre un enlace iónico puro y un enlace covalente que es apolar. Se produce cuando se da el compartimiento de electrones entre dos o más átomos que tienen diferente electronegatividad, produciéndose una separación de las cargas o la distribución de estas entre los núcleos de forma asimétrica. En este tipo de enlace se pueden dar diferentes grados de polaridad en los enlaces. Su característica más importante es el grado de simetría que se encuentra determinado por la diferencia que hay entre la electronegatividad de los átomos.
Tipos
Existen también diferentes tipos de enlaces, como por ejemplo:
- Enlace simple: es un par electrónico compuesto por un electrón del último nivel de energía de cada átomo y se representa con una línea.
- Enlace doble: está compuesto por dos pares electrónicos compartidos o dos electrones que pertenecen al último nivel de energía de cada átomo y se representa con dos líneas paralelas.
- Enlace triple: está formado por tres pares electrónicos lo que quiere decir tres electrones que pertenecen al último nivel de energía de cada átomo y se representa con tres líneas paralelas
- Enlace covalente dativo o de coordinación: este enlace es un par electrónico compartido por dos átomos pero ambos electrones son aportados por el mismo átomo.
Propiedades
Los enlaces covalentes pueden formarse cuando se encuentran en estado líquido, aunque también pueden presentarse en estado gaseoso o sólido. Tienen por esta razón la propiedad de mantener sus puntos de fusión y de ebullición a temperaturas normales. Tienen la capacidad de ser solubles en solventes que sean apolares. Son muy malos conductores de electricidad y de calor. Tienen dos diferentes fuerzas de atracción entre las moléculas, lo que es conocido como fuerza intermolecular, y esta es la razón por la cual sus uniones no son tan fuertes.
Ejemplos de enlace covalente
- Alcohol Metílico: CH3OH
- Alcohol Etílico: C2H5OH
- Alcohol Propílico: C3H7OH
- Éter Metílico: CH3OCH3
- Éter Metiletílico: C2H5OCH3
- Éter Etílico: C2H5OC2H5
- Ácido Fórmico: HCOOH
- Ácido Acético: CH3COOH
- Ácido Propiónico: C2H5COOH
- Ácido Butírico: C3H7COOH
- Dióxido de Carbono: CO2
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Enlace covalente. Recuperado el 5 mayo, 2025, de Euston96: https://www.euston96.com/enlace-covalente/