Fuerzas intermoleculares
En el campo de la química, la biología y la física, existe un grupo de fuerzas intermoleculares que actúen en los grupos de moléculas consideradas como estables o en algunos grupos funcionales que contienen moléculas de gran tamaño o macromoléculas. Este tipo de fuerza es también conocida como la fuerza de Van de Waals. Son fuerzas que a pesar de ser débiles pueden generar una gran cantidad de fenómenos y brindan una explicación sobre el porqué algunas moléculas que son ligeras son líquidas o sólidas a una determinada temperatura y presión, por lo general, normales.
¿Qué son las fuerzas intermoleculares?
Las fuerzas intermoleculares son todas aquellas interacciones que tienen como función principal el poder mantener unidas a las moléculas, son un tipo de fuerza electrostática que le brinda una serie de propiedades a los líquidos y a los sólidos.
Definición
Importante es recordar que en el interior de una molécula existen átomos y que éstos permanecen unidos. Esta unión se da gracias a las fuerzas intermoleculares, que pueden ser enlaces iónicos o covalentes esencialmente. Este tipo de fuerza es la que se encarga de mantener unidas a todas las moléculas y además, son las que se encargan de proporcionar una serie de características con respecto al a parte química de las sustancias.
Características de las fuerzas intermoleculares
Las principales características que pueden ser observadas en las fuerzas intermoleculares son las siguientes:
- No tienen la misma fuerza que las intramoleculares.
- Tiene la capacidad de poder ejercer una atracción entre las moléculas que forman parte de una sustancia determinada.
- Su intensidad tiende a reducirse de manera drástica cuando la distancia que existe entre las moléculas se aumenta.
- Este tipo de fuerza no tienen ningún tipo de ventaja en los gases.
- Se puede ver reflejada en las diferentes propiedades que tienen los líquidos como por ejemplo en el punto de fusión y en el de ebullición.
- Tienen un orden de magnitud el cual es relativo y se basa en el enlace de hidrógeno, el dipolo-dipolo y la dispersión de London.
- Se presenta ante la presencia o la ausencia de los electrones.
- Las diferentes fuerzas intermoleculares que pueden actuar entre las moléculas se pueden clasificar en dipolos permanentes, inducidos, dispersos y por último, los puentes de hidrógeno
Tipos de fuerzas intermoleculares
Existen varios tipos de fuerzas intermoleculares las cuales se mencionan a continuación.
Fuerza de Van der Waals
Este tipo de fuerza se ubica en el grupo de produce estabilización de las moléculas formando un enlace químico no covalente en el cual dos tipos de fuerzas participan, una es la de dispersión o atracción y las otras, de repulsión. La fuerza de dispersión es electrostática porque los átomos tienen la capacidad de formar dipolos pequeños que, cuando los electrones giran alrededor del núcleo, el dipolo hace que los átomos se polaricen creando pequeñas fuerzas de atracción entre los dipolos.
La repulsión electrostática se da en las capas electrónicas de los átomos que se ubican contiguos y el resultado es una distancia mínima entre los dos núcleos. Cabe mencionar que la energía que tiene el enlace de Van der Waals es de 1 – 2 kcal/mol. Por último, el enlace de Van der Waals tiene tres tipos o clases de enlace, los de orientación, los de inducción y los de dispersión.
Fuerzas ion-dipolo
Este tipo de fuerza intermolecular se presenta cuando los iones que existen en una determinada sustancia pueden interactuar con los dipolos que hay en una molécula covalente polar. En el enlace polar, el átomo que presenta una mayor electronegatividad tienen la capacidad de atraer electrones y de esta manera produce un dipolo negativo alrededor de él mientras que se forma al mismo tiempo un dipolo positivo en el lugar donde hay menos cantidad de electronegatividad.
En las fuerzas ion-dipolo, el catión tienen un tipo de atracción electrostática y es atraído por el dipolo negativo, el anión por su parte se atrae gracias a la fuerza electrostática hacia el dipolo que se encuentra positivo.
Fuerzas de Maxwell
Este tipo de fuerza se refiere a los diferentes campos eléctricos y magnéticos que existen en el tiempo y que influyen en las ondas electromagnéticas. Son cuatro diferentes fuerzas, la de gravedad, el electromagnetismo, la interacción nuclear fuerte y la débil.
Propiedades
Las propiedades de las fuerzas intermoleculares dependerán del efecto que éstas producen las propiedades físicas y químicas de los elementos. Dicho esto, existen propiedades relacionadas con el estado de agregación, con el punto de fusión y de ebullición, la solubilidad, la densidad de la molécula y la viscosidad.
En qué se diferencian de las fuerzas intramoleculares
Las fuerzas intramoleculares son aquellas que unen a los átomos dentro de una molécula y son fuerzas que para que puedan ser ejecutadas necesitan de la presencia de un cambio químico para luego determinar las propiedades químicas que se encuentran en una determinada sustancia. Por su parte, las fuerzas intermoleculares actúan sobre las moléculas haciendo que estos se repelen o se atraigan, se encargan entonces de determinar las diferentes propiedades físicas de los elementos.
Importancia
Este tipo de fuerza es importante principalmente en los gases pues son las responsable de cómo estos pueden llegar a comportarse. También tienen un papel fundamental en los estados de agregación de la materia, con esto nos referimos a los estados líquidos, sólidos o gaseosos. Estos enlaces participan activamente en una serie de procesos en las especies vivas y en los sistemas biológicos com por ejemplo en la catálisis enzimática.
Sin este tipo de fuerza, la vida prácticamente no podría existir pues son las encargadas de darle las propiedades a las sustancias, por ejemplo, si el agua no tuviera enlaces por medio de las fuerzas intermoleculares, cambiaría de estado con mucha facilidad y no podría desarrollarse ningún tipo de vida en la tierra. Son fuerzas que están presentes en el alcohol, en el ADN, en los carbohidratos, proteínas, glucosa y celulosa, sin ellas, todas estas sustancias y muchas más no podrían existir.
Ejemplos de fuerzas intermoleculares
Amoniaco
El amoniaco tiene dos tipos de fuerzas intermoleculares, la de London y la interacción entre los dipolos. Esto sucede porque en este elemento existe una nube eléctrica libre y por esta razón, los dipolos son diferentes a cero.
Etanol
El etanol es un líquido muy volátil y utiliza fuerzas dipolo-dipolo para controlar su peso molecular. Posee una gran cantidad de puentes de hidrógeno y gracias a la fuerza intermolecular, esta sustancia tiene un punto de ebullición bastante elevado.
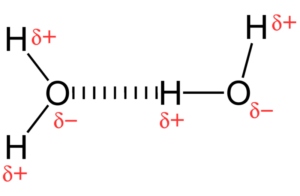
Agua
El agua posee fuerzas intermoleculares intensas y son conocidas como puentes de hidrógeno, éstas actúan por medio de una fuerza dipolo-dipolo que se da entre el átomo de hidrógeno y el átomo electronegativo. Tiene además elementos de pequeño tamaño así como una gran electronegatividad lo que hace que se produzcan cargas parciales.
Metano
El metano posee fuerzas intermoleculares de London y de dipolo permanente pues cuenta con moléculas no polares.
Alcohol etílico
Esta sustancia también posee puentes de hidrógeno, considerados como las principales fuerzas intermoleculares y por esta razón, este tipo de alcohol posee un elevado punto de ebullición. Además, está bastante polarizado debido a los enlaces de hidrógeno y oxígeno.
Diamante
La estructura de los diamantes depende de las fuerzas intermoleculares las cuales se basan en la formación de enlaces de hidrógeno.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2020). Fuerzas intermoleculares. Recuperado el 3 mayo, 2025, de Euston96: https://www.euston96.com/fuerzas-intermoleculares/