Gases nobles
Los gases nobles son un grupo de elementos de origen químico que poseen una serie de propiedades muy similares. Bajo condiciones normales, son gases monoatómicos, inodoros e incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 de la tabla periódica. Los gases nobles son sustancias químicas muy estables las cuales no reaccionan fácilmente con otras sustancias químicas y no son inflamables. Muchos se encuentran normalmente en el aire. Esto significa, por ejemplo, que todos los días respiramos pequeñas cantidades de gases nobles. Aunque estos gases no son muy tóxicos, cuando los encontramos en cantidades muy grandes pueden causar daño al ser humano. Los gases nobles son altamente asfixiantes. Los gases asfixiantes reemplazan el oxígeno en el aire de modo que quede menos oxígeno para respirar. Sin oxígeno, una persona puede morir. Los siete gases son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radiactivo radón (Rn) y el sintético oganesón (Og).

Artículos relacionados
Helio, Neón, Argón, Kriptón, Xenón, Radón
¿Qué son los gases nobles?
Los gases nobles son un grupo de elementos químicos que tienen propiedades muy parecidas los cuales bajo condiciones normales son monoatómicos, inodoros, incoloros y tienen una reactividad química sumamente baja. Se sitúan en el grupo 18 de la tabla periódica. Son, además, químicamente inertes y no reaccionan ante otros elementos químicos, de ahí se deriva su nombre.
Historia de los gases nobles
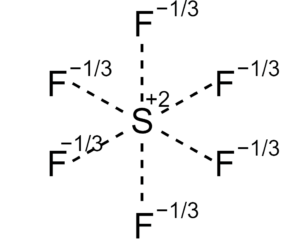
La palabra gas noble es una traducción derivada del alemán Edelgas, y fue utilizado por primera vez en 1898 por Hugo Erdmann, quien utilizó la palara para indicar el bajo nivel de reactividad de dichos gases. Este nombre, hace una analogía a la frase “metales nobles”, como, por ejemplo, el oro, el cual se encuentra asociado con riqueza y nobleza. Pierre Janssen y Joseph Norman Lockyer fueron los primeros en descubrir un gas noble el 18 de agosto de 1868 cuando se encontraban estudiando la cromosfera del sol, entonces lo llamaron helio pues la palabra griega para el sol. Su descubrimiento ayudó a los científicos a tener una mejor compresión de la estructura atómica. En 1895, el químico francés Heri Moissan trató sin resultados positivos de producir una reacción entre el flúor, el elemento más electronegativo que existe, y el argón, uno de los gases nobles, con el fin de aislar de la atmósfera aquellos gases caracterizados por su extraordinaria inercia química, comenzando por el que está en mayor abundancia relativa, y de crear nuevos elementos o compuestos, sin embargo esto fue imposible, pero colaboraron a desarrollar teorías diferentes y nuevas con respecto a la estructura atómica de los elementos. En el año 1962, Neil Bartlett descubrió el primer compuesto químico de un gas noble, el hexafluoroplatinato de xenón.
Características de los gases nobles
Son gases monoatómicos lo que quiere decir que poseen un único átomo, no tienen olor pues son completamente inodoros, no tienen color y tienen una reactividad química muy baja. Están situados en el grupo 18 (8A) de la tabla periódica de los elementos, el cual anteriormente se conocía con el nombre de grupo 0. Tienen 8 electrones en el último nivel de energía. No son reactivos y todos son no-metales. Los gases nobles tienen las capas de electrones “s” y “p” completas lo que los hacer ser elementos muy estables. No tienen necesidad de aumentar o de disminuir su cantidad de electrones para lograr aumentar su estabilidad como otros elementos. Sus puntos de ebullición de fusión son muy bajos.
Usos y aplicaciones de los gases nobles
Los gases nobles se utilizan en grandes cantidades dentro de la industria electrónica, como parte de bombillas para pantallas de computadoras, televisores y proyectores. Se mezclan con halógenos (cloro y flúor) para crear los láseres ultravioletas utilizados en la fabricación de circuitos integrados. Tienen un punto de ebullición y de fusión muy bajos, lo que los hace útiles como refrigerantes criogénicos. Son utilizados para la iluminación porque su reactividad química es nula. El argón, por ejemplo, mezclado con nitrógeno, se utiliza como gas de relleno de las bombillas incandescentes. El helio se utiliza como componente de los gases respirables como sustituyente del nitrógeno. La baja solubilidad del helio nos proporciona aún más ventajas para el trastorno conocido como enfermedad por descompresión. A menor cantidad de gas que se disuelve dentro del cuerpo se formarán menos cantidades de burbujas de gas durante la reducción de la presión durante el ascenso. Se mezclan con halógenos como el cloro y el flúor para poder crear los láseres ultravioletas utilizados en la fabricación de circuitos integrados. Otras aplicaciones y ejemplo de los usos de los gases nobles son las siguientes: Son usados como fuentes de luz y laceres y son utilizados en el área médica, principalmente en odontología y oftalmología.
Ejemplos de gases nobles
Los Gases Nobles son los siguientes:
¿Cómo citar este artículo?
Briceño V., Gabriela. (2017). Gases nobles. Recuperado el 5 enero, 2025, de Euston96: https://www.euston96.com/gases-nobles/