Ley de Avogadro
La ley de Avogadro también llamada con el nombre de hipótesis de Avogadro o el principio de Avogadro es una ley de los gases que nos indica que bajo las mismas condiciones de presión y temperatura, los volúmenes iguales de poseen todos los gases contienen la misma cantidad de moléculas. La ley lleva el nombre de Amedeo Avogadro que, en 1811, planteó la hipótesis de que dos muestras dadas de un gas ideal con el mismo volumen y a la misma temperatura y presión, contienen el mismo número de moléculas; y por lo tanto, el número de moléculas o átomos en un volumen específico de gas ideal es independiente de su tamaño o la masa molar del gas.
Temas relacionados
Ecuación de continuidad, ley de Boyle, ley de Charles, ley de Gay-Lussac, ley de los gases ideales, número de Avogadro
¿Qué es la ley de Avogadro?
La ley de Avogadro o hipótesis de Avogadro es una ley de los gases que se encarga de establecer una relación entre el volumen y la cantidad de gas a presión y sobre las temperaturas que son constantes.
En qué consiste la ley de Avogadro
La ley de Avogadro señala que, para una masa de un gas ideal, el volumen del gas y el número de moles son directamente proporcionales si la temperatura y la presión son constantes. De la ley de se puede deducir que para una masa determinada de un gas ideal, su volumen y la cantidad de moléculas son directamente proporcionales siempre y cuando la temperatura y la presión sean constantes. La consecuencia más significativa que nos ha dejado como enseñanza la ley de Avogadro es que la constante R para los gases ideales tiene el mismo valor para todos los gases.
Historia
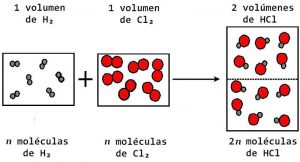
Amadeo Avogadro, un importante físico italiano, propuso en el año 1811 dos diferentes hipótesis, una de ellas decía que los átomos de los gases elementales se encontraban juntos en las moléculas en lugar de estar en átomos separados, como lo había afirmado John Dalton. La segunda hipótesis que tenía decía que los volúmenes iguales de gases a presión y temperatura constantes tenían la misma cantidad de moléculas.
La hipótesis de Avogadro que estaba relacionada con el número de moléculas que tenían los gases no fue aceptada hasta 1858, cuando el químico italiano Stanislao Cannizzaro construyó un sistema lógico basado en la hipótesis.
Quién propuso la ley de Avogadro
La ley fue propuesta por primera vez en el año 1811 por Amedeo Avogadro, un profesor de física superior que trabajó en la Universidad de Turín durante muchos años, pero su teoría no fue bien aceptada hasta después del año 1858, cuando un químico italiano, Stanislao Cannizzaro, construyó un sistema lógico de química basado en ella.
Enunciado
La hipótesis o ley de Avogadro se puede enunciar de la siguiente manera:
«Volúmenes iguales de gases diferentes contienen el mismo número de partículas, a la misma presión y temperatura«
Fórmula
Matemáticamente puede expresarse con la siguiente ecuación:
V/n= K
V= volumen del gas, generalmente expresado en litros.
n = cantidad de la sustancia medida en moles.
Asimismo, de la llamada ley de los gases ideales se tiene lo siguiente:
PV= nRT
P= la presión del gas se suele expresar en atmósferas (atm), en mm de mercurio (mmHg) o en Pascal (Pa).
En la actualidad, sabemos que la presión y temperatura que son constantes, la misma cantidad de gas tiene el mismo volumen independientemente del elemento químico que lo forme. El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n). Por lo tanto la fórmula de la ley de Avogadro es la siguiente:
V1 / n1 = V2 / n2
Y por consiguiente:
- Si aumenta la cantidad de gas, aumenta el volumen.
- Si disminuye la cantidad de gas, disminuye el volumen.
Experimentos
Se puede poner a prueba la hipótesis de Avogadro de la siguiente manera:
A 0ºC tienes un matraz de 500,0 mililitros al que puedes añadir o sacar gas, una balanza que mide su masa y un manómetro que mide la presión. Cuando se presiona el botón «tare» se tendrá que descontar de las medidas la masa del matraz.
Luego se introduce gas en el matraz hasta llegar a una presión determinada; se debe de anotar la masa de dicho gas. Este procedimiento se repite con los otros gases para comprobar que: si el volumen, la presión y la temperatura son constantes en todos los casos hay la misma cantidad de partículas (aunque las masas sean diferentes).
Aplicaciones de la ley de Avogadro
La ley de los gases o de Avogadro puede ser utilizada para lograr explicar la mecánica por la cual se ven afectados la presión, la temperatura y el volumen. Por ejemplo lo podemos observar en los aires acondicionados, las refrigeradores y en la formación de las nubes.
Importancia
La ley de Avogadro ha sido de gran importancia para el mundo de la química pues por medio de ella se logra conocer el número de moléculas que se encuentran contenidas en un mol.
Ejemplos
Algunos ejemplos de ejercicios ya resueltos con respecto a la ley de Avogadro son:
Ejemplo 1: 0,5 moles de un gas que ocupan 2 litros. Calcular cual será el nuevo volumen si se añade 1 mol de gas a presión y temperaturas constantes.
V1 / n1 = V2 / n2
V1 = 2 litros
n1 = 0,5 moles
n2 = 0,5 + 1 = 1,5 moles
V2 = V1 · n2 / n1 = 2 · 1,5 / 0,5 = 6 litros
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Ley de Avogadro. Recuperado el 4 mayo, 2025, de Euston96: https://www.euston96.com/ley-de-avogadro/