Ley de Boyle
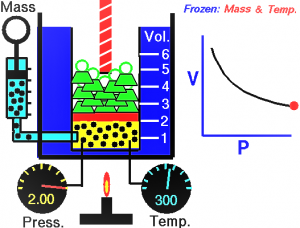
La ley de Boyle fue descubierta por Robert Boyle en el siglo XVII, y fue la ley que estableció las bases para poder explicar la relación que existe entre la presión y el volumen que existe en un gas. Por medio de una serie de experimentos, logró demostrar que, si había una temperatura constante, un gas al ser sometido a más presión reduce su volumen, mientras que si la presión decrece el volumen aumenta.
¿Qué es la ley de Boyle?
La ley de Boyle es una ley relacionada con los gases que establecen una relación entre la presión y el volumen que tiene una determinada cantidad de gas, sin que hayan variaciones en la temperatura, es decir, a temperatura constante.
En qué consiste la ley de Boyle
En el año 1662 Robert Boyle, descubrió que la presión que era aplicada a un gas era inversamente proporcional a su volumen a temperatura y numero de moles constante. En otras palabras que si se aumenta del doble la presión ejercida sobre el gas, este mismo gas se comprimía reduciendo su volumen a la mitad.
Cuando el volumen del recipiente que contiene el gas aumenta, la distancia que las partículas tienen que pasar antes de colisionar contra las paredes del recipiente también aumentan. Este aumento de distancia hace que los choques sean menos frecuentes, y por lo tanto la presión en las paredes sea inferior a la ejercida anteriormente cuando el volumen era inferior.
Historia
La ley de Boyle fue descubierta por primera vez por Robert Boyle en el año 1662,. Edme Mariotte fue otro científico que también tenía el mismo pensamiento y que llegó a la misma conclusión que Boyle, sin embargo, Mariotte no hizo públicos sus trabajos sino hasta el año 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de ley de Boyle y Mariotte.
Quién la propuso
La ley de Boyle-Mariotte, o ley de Matute como también es conocida fue formulada de forma independiente por el físico y químico británico Robert Boyle y por el físico y botánico francés Edme Matute. Es una de las leyes que se refiere a la forma en la que los gases relacionan el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante.
Enunciado de la ley de Boyle
El enunciado de la ley de Boyle es el siguiente: la presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga de manera constante. O en términos más sencillos lo podemos explicar cómo: A mayor temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce constante.
Fórmula
La ley de Boyle puede ser expresada de forma matemática de la siguiente manera:
P · V = k
Donde:
- P es presión
- V es Volumen
- k es una constante que nos indica cuando la temperatura y masa son constantes.
Esta fórmula también puede ser utilizada para poder determinar el cambio de presión o temperatura durante una transformación isotérmica de la siguiente manera:
P1 · V1 = P2 · V2
Esto quiere decir, que el producto entre la presión inicial y el volumen inicial es igual al producto de la presión final por el volumen final.
Experimentos
Para poder probar la teoría de la ley de Boyle, Mariotte se encargó de introducir un gas dentro de un cilindro con un émbolo y logró comprobar las diferentes presiones que eran creadas cuando se bajaba el émbolo. De este experimento se dedujo que cuando se aumentaba el volumen, la presión entonces disminuía.
Aplicaciones
La ley de Boyle tiene muchas aplicaciones en la vida moderna, entre ellas podemos mencionar por ejemplo el buceo, esto se debe a que el buzo debe expulsar el aire de sus pulmones cuando asciende porque este se expande al disminuir la presión y de no hacerlo podría causar daño al tejido.
Se puede observar en todos los aparatos que utilizan o que funcionan por medio de la energía neumática como por ejemplo los brazos robóticos los cuales utilizan pistones neumáticos, actuadores, reguladores de presión y válvulas liberadoras de presión entre otros componentes más.
Los motores a gasolina, gas o diésel también utilizan la ley de Boyle en el proceso de la combustión interna, ya que en un primer tiempo determinado ingresa el aire al cilindro con volumen y presión, y en un segundo tiempo, se disminuye el volumen al aumentar la presión de este.
El sistema de airbag que poseen los automóviles, el cual funciona por medio de una descarga de una cantidad de aire o gas determinada desde una cámara que llega hasta la bolsa exterior, lugar en el cual la presión disminuye y el volumen aumenta manteniendo una temperatura constante.
Importancia
La ley de Boyle es muy importante en la actualidad porque es la ley que nos habla y explica sobre el comportamiento que tienen los gases. Nos explica, con certeza, que la presión y el volumen que tiene un gas es inversamente proporcional entre sí con otro. Entonces, cuando se hace presión sobre el gas, su volumen se reduce y la presión aumenta.
Ejemplos de la ley de Boyle
Algunos ejemplos de esta ley tan importante son los siguientes:
Calcular el volumen que ocupará un gas, que está ocupando un volumen de 3.75 litros, a una presión de 2 at si se le aplica una presión de 3.5 at.
- V1 = 3.75 l
- P1 = 2 at
- V2 = ?
- P2 = 3.5 at
- Como V1P1 = V2P2 = k
Calculamos la constante del sistema:
- V1P1= k = (3.75)(2) = 7.5
Despejamos V2:
- V2 = k/P2 = 7.5/3.5 = 2.143 litros
Calcular la presión original de un gas, si al aplicarle una presión de 4.5 at, ocupa un volumen de 1.4 litros, y su volumen original era de 2.2 litros.
- V1 = 2.2 l
- P1 = ?
- V2 = 1.4 l
- P2 = 4.5 at
Calculamos la constante del sistema:
- V2P2= k = (1.4)(4.5) = 6.3
Despejamos P2:
- P1 = k/V1 = 6.3/2.2 = 2.863 at
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Ley de Boyle. Recuperado el 4 enero, 2025, de Euston96: https://www.euston96.com/ley-de-boyle/