Ley de Gay-Lussac
Uno de los aspectos más asombrosos que podemos conocer sobre los gases es que, a pesar de las grandes diferencias en las propiedades químicas que tiene cada uno de ellos, todos los gases obedecen más o menos a las leyes de los gases. Las leyes de los gases se refieren a cómo se comportan los gases con respecto a la presión, el volumen, la temperatura y la cantidad.
La ley de Gay-Lussac establece que cuando los gases reaccionan, lo hacen en volúmenes que tienen una relación simple entre sí, y que al volumen del producto formado, si es gaseoso, mantiene la temperatura y la presión constantes.
En qué consiste la ley de Gay-Lussac
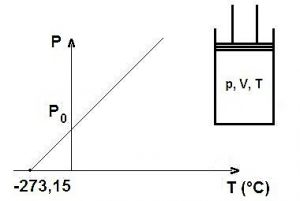
La ley de Gay-Lussac es una ley que nos dice que dependiendo del volumen que exista de manera constante, la presión de un gas será directamente proporcional a la temperatura. Cuando se aumenta la temperatura, las moléculas que tiene un gas se movilizan más rápidamente y por esta razón aumenta el número de choques que se da contra las paredes, en otras palabras, se aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Consiste en establecer una relación entre el presión y la temperatura de un gas ideal, manteniéndolo a un volumen constante, por medio de una constante de proporcionalidad directa. En la se nos dice que cuando hay un volumen constante, al aumentar la temperatura, la presión del gas aumenta y cuando se disminuye la temperatura, presión del gas disminuye.
Historia
La ley fue publicada primero por Louis Joseph Gay-Lussac en 1802, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
Quién la propuso
El científico que propuso la ley fue Gay-Lussac quien nació en St. Leonard, un pueblo al sur de Francia, y quien estudió en la Escuela Politécnica de París. Al salir de ésta, en 1801, inició su trabajo en el Departamento de Caminos y Puentes. Inició sus investigaciones al ser elegido por Berthollet para trabajar como su asistente en los establecimientos químicos del gobierno.
Enunciado de la ley de Gay-Lussac
La ley de Gay-Lussac establece como enunciado que:
«A volumen constante, la presión que ejerce el gas es directamente proporcional a la temperatura absoluta que soporta»
Formula
La ecuación o fórmula matemática que nos explica la ley de Gay-Lussac se escribe de la siguiente forma:
P1/T1 = P2/T2
donde:
- P1 = Presión Inicial
- T1 = Temperatura Inicial
- P2 = Presión Final
- T2 = Temperatura Final
Experimentos
Algunos experimentos que se pueden hacer con esta ley son:
Experimento 1
Materiales:
- Tubo de ensayo
- Agua
- Corcho
- Vela
Procedimiento:
- En un tubo de ensayo se deposita un poco de agua y se tapa el tubo con un corcho.
- Luego se empieza a calentar el tubo con una vela, el gas que había dentro del tubo (el vapor generado por el agua y el aire) empezara a expandirse.
- Se necesitara una vía de escape así que el corcho saldrá volando y el gas ya podrá salir tranquilamente.
Experimento 2
Materiales:
- Botella de vidrio
- Vela
- Globo de caucho
Procedimiento:
- En la punta de la botella pondremos la boca del globo y luego calentaremos la botella.
- Después de un buen rato el gas se expenderá hasta inflar el globo de caucho.
Aplicaciones
Algunas de las aplicaciones en las cuales podemos observar esta ley son las siguientes:
- La ley de Gay-Lussac es aplicada en nuestra vida diaria por ejemplo en las ollas a presión en las cuales cuando se aumenta la temperatura de la olla, el gas en el interior elevara su presión.
- Para diseñar propulsores en latas la presión de manera que el gas se pueda acumular y después tener una salida controlada.
- En las latas de soda o refresco como popular se conocen, se hace uso de los gases, ya que la cantidad de gas que se encuentra disuelta en un líquido es directamente proporcional a la presión que ejerce ese gas sobre el líquido. Al ser la soda un líquido que usa dióxido de carbono, cuando se abre la lata escapa el gas y el carbono disuelto se eleva hasta arriba y escapa, de ahí el sonido que emite.
Importancia de la ley de Gay-Lussac
Básicamente, la importancia que tiene esta ley de gas es que nos indica que al aumentar la temperatura de un gas, su presión aumenta proporcionalmente, asumiendo que el volumen no cambia. De manera muy parecida, cuando se disminuye la temperatura, la presión cae de manera proporcional.
Ejemplos
En la vida cotidiana la ley de Gay-Lussac tiene una amplia gama de aplicaciones y algunos de los ejemplos más comunes se mencionan a continuación:
- Cuando un neumático de un automóvil se encuentra en llamas: la goma que se está quemando va a provocar un aumento en la presión del aire en el neumático porque se da un aumento en la temperatura lo que puede provocar una explosión de la pared del neumático.
- Cuando se dispara una bala: la ley de Gay-Lussac se puede aplicar en este caso cuando el encendido de la pólvora forma un gas sobrecalentado que al mismo tiempo aumenta la presión haciendo que la bala viaje a alta velocidad por mucho más tiempo.
- Cuando se calienta una lata de aerosol que está cerrada: el aumento de la temperatura aumenta la presión que podría llegar a provocar la explosión del contenedor. Por esto vemos una advertencia en las botellas de desodorante y oros productos enlatados.
- Calentamiento de alimentos en un horno: al colocar los alimentos en un horno para calentarlos, el aire dentro del horno se calienta y se presuriza.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Ley de Gay-Lussac. Recuperado el 4 mayo, 2025, de Euston96: https://www.euston96.com/ley-gay-lussac/